Practica 7: “DETERMINACIÓN DE SOLUBILIDAD”
Objetivo: Determinar
la solubilidad de un compuesto a diferentes temperaturas
Introducción: La so0lubilidad máxima de una sustancia que se disuelve en
100grs de disolvente a una temperatura determinada. Dicha capacidad puede ser
expresada en moles por litro o también en porcentaje de soluto.
·
Solubilidad: Es la capacidad cuando una cantidad de soluto puede estar
disuelto en el solvente comprendido en una temperatura determinada
·
Disolvente: Es el medio donde el soluto se disuelve para formar la
solución, normalmente está a mayor cantidad que el soluto.
·
Soluto: Es el compuesto
normalmente en menor cantidad para la solución
·
Solución saturada: Es el equilibrio entre el soluto y el solvente a una
temperatura determinada.
·
Sobresaturación: Se dice que una solución esta sobresaturada cuando existe
soluto sin disolverse en la disolución.
La interacción de las
moléculas del disolvente con las del soluto, para conseguir formar agregados se
conoce como solvatación, pero si el solvente es agua, este proceso se conoce
como hidratación.
La solubilidad se ve afectada
por diferentes factores, y ésta vine determinada por el equilibrio de las
fuerzas internas que existen entre los disolventes y los solutos. la
temperatura o la presión, son factores, que al romper el equilibrio, afectan la
solubilidad.
Sometidos a altas
temperaturas, la solubilidad de los solutos iónicos, se ven disminuidos debido
a que las propiedades cambian y el agua se convierte en menos polar, al
reducirse la constante dieléctrica.
FACTORES QUE AFECTAN LA SOLUBILIDAD DE LAS SUSTANCIAS.
En la mayoría de los casos, los solutos se disuelven en disolventes que tienen una polaridad similar. Los químicos usan un aforismo popular para describir esta característica de solutos y disolventes: “semejante disuelve semejante”.Los solutos no polares no se disuelven en disolventes polares y viceversa (Educating online, S.F.).
EFECTO DE ION COMUN.
El efecto ion común, es un término que describe la disminución en la solubilidad de un compuesto iónico cuando se añade a la mezcla una sal que contiene un ion que ya existe en el equilibrio químico.
TEMPERATURA
 La temperatura tiene un efecto directo sobre la solubilidad. Para la mayoría de los sólidos iónicos, el aumento de la temperatura aumenta la rapidez con la que se puede hacer la solución.A medida que la temperatura aumenta, las partículas del sólido se mueven más rápido, lo que aumenta las posibilidades de que interactúen con más partículas del disolvente. Esto da como resultado el aumento de la velocidad a la que se produce una solución.La temperatura también puede aumentar la cantidad de soluto que se puede disolver en un disolvente. En términos generales, a medida que aumenta la temperatura, se disuelven más partículas de soluto.
La temperatura tiene un efecto directo sobre la solubilidad. Para la mayoría de los sólidos iónicos, el aumento de la temperatura aumenta la rapidez con la que se puede hacer la solución.A medida que la temperatura aumenta, las partículas del sólido se mueven más rápido, lo que aumenta las posibilidades de que interactúen con más partículas del disolvente. Esto da como resultado el aumento de la velocidad a la que se produce una solución.La temperatura también puede aumentar la cantidad de soluto que se puede disolver en un disolvente. En términos generales, a medida que aumenta la temperatura, se disuelven más partículas de soluto.
PRESION
El segundo factor, la presión, afecta a la solubilidad de un gas en un líquido pero nunca de un sólido que se disuelve en un líquido.Cuando se aplica presión a un gas que está por encima de la superficie de un disolvente, el gas se moverá al disolvente y ocupará algunos de los espacios entre las partículas del disolvente.Un buen ejemplo es la soda carbonatada.
NATURALEZA DEL SOLUTO.
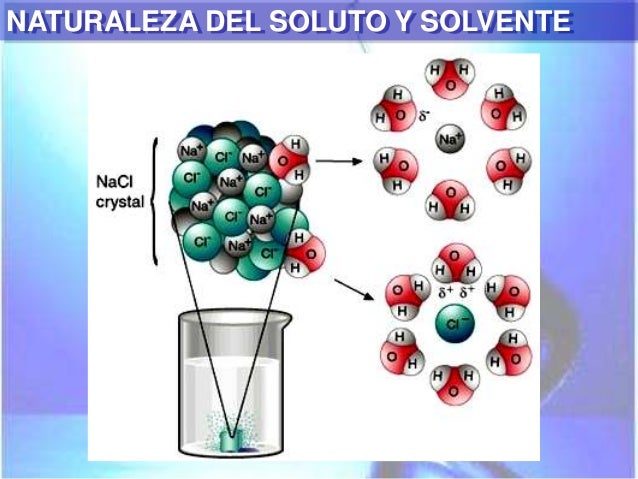 La naturaleza del soluto y del solvente y la presencia de otros compuestos químicos en la solución afectan la solubilidad.
La naturaleza del soluto y del solvente y la presencia de otros compuestos químicos en la solución afectan la solubilidad.
FACTORES MECANICOS
En contraste con la velocidad de disolución, la cual depende principalmente de la temperatura, la velocidad de recristalización depende de la concentración de soluto en la superficie de la red cristalina, caso que se favorece cuando una solución está inmóvil.Por lo tanto, la agitación de la solución evita esta acumulación, maximizando la disolución. (tipes of saturation, 2014).
TIPOS DE SOLUCIONES
Tipos de soluciones según el
nivel de mezcla
La primera clasificación nos
indica si los componentes de la solución se pueden diferenciar por separado, o
no:
Solución homogénea, en la que
sus componentes se mezclan de tal forma que no se pueden diferenciar.
Solución heterogénea, lo cual
implica que sí podemos diferenciar un componente de otro.
Tipos de soluciones según su
carga eléctrica
Como casi todo en este mundo,
las soluciones también pueden tener una carga eléctrica, dependiendo de sus
componentes. Según esta característica, las podemos clasificar en
Soluciones no electrolíticas:
Tienen una escaza posibilidad de transmitir electricidad y se caracterizan,
principalmente, porque el soluto se disgrega casi hasta su estado molecular.
Soluciones electrolíticas. Por
otro lado, las soluciones electrolíticas sí pueden cargar electricidad. A este
tipo de soluciones se las puede llamar también iónicas.
Tipos de soluciones según la
concentración
La solubilidad es un término
que indica la capacidad del solvente para disolver el soluto. Si la solubilidad
es alta, el segundo se disuelve bien; si no, la solubilidad es baja. La
concentración del soluto en el solvente nos habla de la concentración. A partir
de esto, obtenemos tres tipos de soluciones.

Soluciones saturadas: son
aquellas en donde hay mayor cantidad de soluto disuelto, o sea está al límite
en cuanto a cantidad de soluto en solvente. Si se agregara más soluto, se
superaría la capacidad de disolución; por ejemplo, si tenemos un vaso con agua
y le vamos agregando de a poco sal, llegará un momento en donde no se disolverá
más, allí estará saturada la solución.
Soluciones insaturadas:
también conocidas como diluidas. Aquí tenemos una pequeña cantidad de soluto en
el solvente; por lo tanto, el primero es casi imperceptible. Un ejemplo de esto
puede ser la preparación de un jugo en polvo en una jarra con agua. Si no
agregamos todo el sobre, el resultado será una preparación sin sabor, o sea
diluida.
Soluciones concentradas o no
saturadas. Estas últimas nos hablan de una solución en donde el porcentaje de
soluto se acerca al establecido por la solubilidad, o sea está cercana esta
solución a saturarse. Ambos componentes están en desequilibrio.
Hay quienes agregan un nivel
intermedio entre las soluciones saturadas y las concentradas, etiquetándolas
como sobresaturadas. En este tipo de solución el soluto en exceso se comienza a
acumular en el fondo, porque ya no se disuelve. Por ejemplo, cuando agregamos
tierra en un recipiente con agua, al principio se hará marrón el solvente, pero
llegará un momento en el que no se disolverá más.
Formas de medir la
concentración
Para medir la proporción de
soluto en solvente usamos unidades de medidas físicas y químicas. Hay distintos
métodos: podemos medir por millón (miligramos en litros o en kilogramos),
también en porcentaje (x soluto por cada 100 partes de solución), en molar
(moles de soluto por litro de solución), en molal (moles de soluto por
kilogramo de solvente), por último tenemos la proporción normal (gramo de
soluto por litro de solvente).
Por otro lado, tenemos dos
métodos que nos sirven para hacer esta medición, el método empírico o visual,
en donde se hace una observación detenida de la solución. Este es un método
cualitativo y no preciso. El método físico es cuantitativo, implica la
realización de cálculos y da resultados precisos.
BIBLIOGRAFIA.
RAFAEL DIAZ. (SF). Los 6
Factores que Afectan la Solubilidad Principales. 26.SEP.17, de LIFEDER Sitio
web: https://www.lifeder.com/factores-afectan-la-solubilidad/
Enciclopedia
de Clasificaciones (2017). "Tipos de soluciones químicas". Recuperado
de: http://www.tiposde.org/quimica/1044-tipos-de-soluciones-quimicas/
Fuente: http://www.tiposde.org/quimica/1044-tipos-de-soluciones-quimicas/#ixzz4tqhDGfUI
Fuente: http://www.tiposde.org/quimica/1044-tipos-de-soluciones-quimicas/#ixzz4tqhDGfUI
EQUIPO 3
ALISON A.
ERICK V.
MANUEL M.
JARED Z.
JOSE F.
SARAI V.
La información presentada, detalla muy bien el aspecto de los conceptos y con ello sus derivaciones como tal en cuanto al tema; como lo que se presenta en una disolución , solutos, disolventes, etcétera.
ReplyDeletePor otro lado me pareció muy bien la utilización de información adyacente al tema, como los tipos de soluciones; siendo muy buena complementación para el trema principal, ya que forma parte de él y además porque es importante saberlo.
También sobre los factores que afectan una solución, desde ión común, factores mecánicos la naturaleza del producto, temperatura, etcétera.
Con todo ello hace de la información presentada muy completa y rica en estructura de presentación.
Muy buen equipo.,
ahhh bueno master
Delete